1과목: 과목구분없음
1. 다음은 수소를 얻는 방법에 대한 설명이다. 
(가)로 가장 적절한 것은?
- 광분해
- 복분해
- 열분해
- 가수 분해
- 전기 분해
2. 다음은 반응 속도를 조절하는 사례이다. 
(가)와 (나)의 반응에서 ㉠과 ㉡에 의해 변화되는 것만을 <보기>에서 있는 대로 고른 것은?
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
3. 다음은 A가 B를 생성하는 열화학 반응식이다. 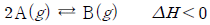
그림은 강철 용기에 A만 넣고 300 K를 유지하며 반응시켰을 때 시간에 따른 A의 농도를 나타낸 것이다. 
동일한 강철 용기에 같은 질량의 A를 넣고 400K를 유지하면서 반응시켜 평형에 도달했을 때, A의 평형 농도는 C2M였고, 평형에 도달하는 시간은 t2초였다. C1과 C2, t1과 t2를 옳게 비교한 것은? (순서대로 평형 농도, 평형에 도달하는 시간)
- C1 < C2, t1 < t2
- C1 < C2, t1 > t2
- C1 > C2, t1 < t2
- C1 > C2, t1 > t2
- C1 = C2, t1 > t2
4. 그림은 300 K, 1기압에서 반응 (가)~(다)의 T△S와 △G를 나타낸 것이다. 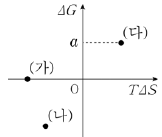
1기압에서 (가)~(다)에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은?
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
5. 표는 수소 화합물 (가)~(라)의 기준 끓는점을 나타낸 것이다. (가)~(라)는 각각 CH4, NH3, SiH4, PH3 중 하나이다. 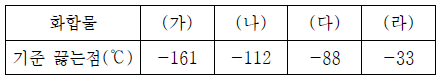
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은?
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄱ, ㄴ, ㄷ
6. 다음은 갈륨(Ga)의 상태 변화와 관련된 열화학 반응식이다. 1기압에서 Ga의 녹는점과 끓는점은 각각 T1K, 2673 K이다. 
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
7. 그림 (가)와 (나)는 각각 금속 A와 이온 화합물 ACl의 결정 구조를 모형으로 나타낸 것이다. (가)와 (나)에서 단위 세포는 한 변의 길이가 각각 a1, a2인 정육면체이다. 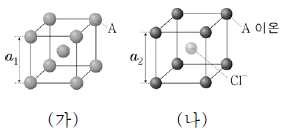
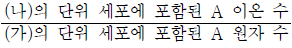 는? (단, A는 임의의 원소 기호이다.)
는? (단, A는 임의의 원소 기호이다.)
- 1/2
- 2/3
- 8/9
- 1
- 2
8. 다음은 25 ℃에서 2가지 화학 전지에서 일어나는 반응식과 표준 전지 전위(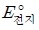 )를 각각 나타낸 것이다.
)를 각각 나타낸 것이다. 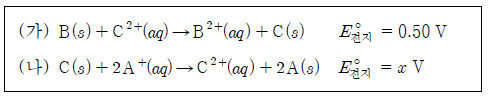
표는 25 ℃에서 금속 A ~ C와 관련된 반쪽 반응과 표준 환원 전위(E°)를 나타낸 것이다.v
x는? (단, A ~ C는 임의의 원소 기호이다.)
- 0.54
- 1.06
- 1.34
- 1.86
- 2.06
9. 그림은 25℃, 1기압에서 몇 가지 반응의 엔탈피(H) 변화를, 표는 2가지 결합의 결합 에너지를 나타낸 것이다. 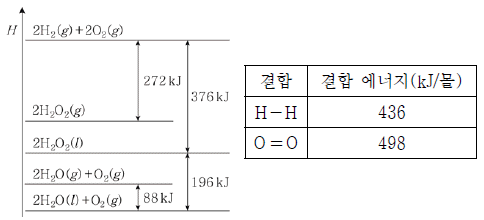
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은? [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
10. 그림 (가)는 25 ℃에서 O와 He의 압력에 따른 용해도를, (나)와 (다)는 25 ℃, 1기압에서 물 1 L가 들어 있는 실린더에 각각 같은 몰수의 O와 He을 넣고 평형에 도달한 상태를 나타낸 것이다. 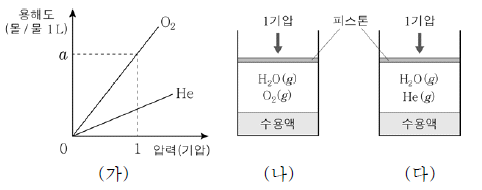
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은? (단, 온도는 일정하고 피스톤의 질량과 마찰은 무시한다.) [3점]
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
11. 다음은 기체의 성질을 알아보기 위한 실험이다. 온도는 일정하다. 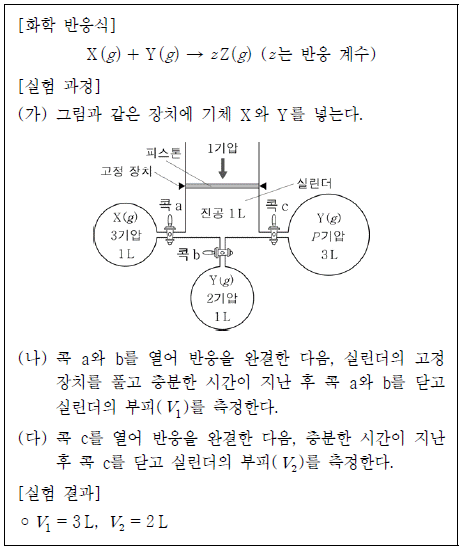
P/x는? (단, 연결관의 부피, 피스톤의 질량과 마찰은 무시하고, 역반응은 일어나지 않는다.) [3점]
- 1/3
- 1/2
- 1
- 3/2
- 2
12. 표는 1기압에서 용매 X 100 g에 용질 A와 B의 질량을 달리하여 녹인 용액 (가)~(다)에 대한 자료이다. 분자량은 A가 B의 2배이다. 
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은? (단, A, B는 모두 비전해질이고, 서로 반응하지 않는다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
13. 그림 (가)는 강철 용기에 X(g)가 들어 있는 것을, (나)는 (가)에 He(g)를 첨가하고 온도를 높인 상태를 나타낸 것이다. X와 He의 분자량은 각각 a, 4이다. 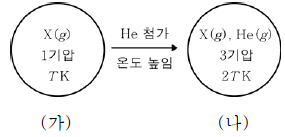
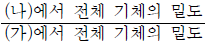 는?
는?
14. 그림은 농도가 서로 다른 A(aq) (가)~(다)를 혼합한 후 증류수를 추가하여 수용액 (라)를 만드는 과정을 나타낸 것이다. A의 화학식량은 24이고 (라)의 밀도는 1.05 g/mL이다. 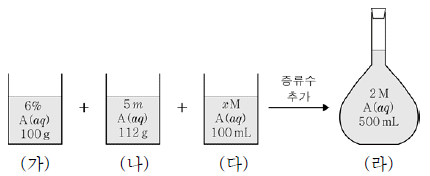
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은? (단, 온도는 일정하다.) [3점]
- ㄱ
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
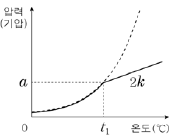
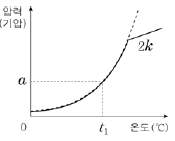
15. 그림에서 (가)는 A(ℓ)의 증기 압력 곡선을, (나)는 진공 강철 용기에 wg의 A(ℓ)를 넣고 가열할 때 온도에 따른 A(g)의 압력을 나타낸 것이다. (나)에서 직선 구간의 기울기는 k이다. 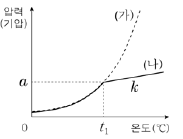
같은 조건에서 2wg의 A(ℓ)를 넣고 가열할 때 온도에 따른 A(g)의 압력을 나타낸 것으로 가장 적절한 것은?
16. 다음은 TK에서 기체 A와 B가 반응하여 기체 C가 생성되는 반응의 화학 반응식과 평형 상수이다. 
그림은 TK에서 콕으로 연결된 강철 용기 (가)와 (나)에서 각각 이 반응이 평형에 도달한 상태를 입자 모형으로 나타낸 것이다.  는 각각 A ~ C 중 하나이고, 모형에서 입자 1개는 1몰을 나타낸다.
는 각각 A ~ C 중 하나이고, 모형에서 입자 1개는 1몰을 나타낸다. 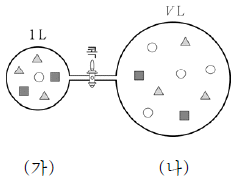
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은? (단, 온도는 일정하고 연결관의 부피는 무시한다.) [3점]
- ㄴ
- ㄷ
- ㄱ, ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
17. 그림 (가)는 물질 X의 상평형 그림을, (나)와 (다)는 실린더에 X를 넣어 압력이 다른 조건에서 평형에 도달한 상태를 각각 나타낸 것이다. 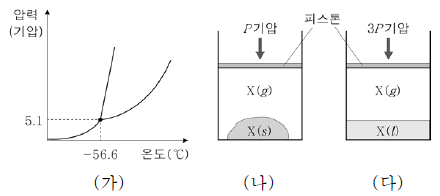
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은? (단, 피스톤의 질량과 마찰은 무시한다.)
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
18. 다음은 2가지 반응의 화학 반응식과 반응 속도식이다. k1, k2는 반응 속도 상수이고, m, n은 반응 차수이다. 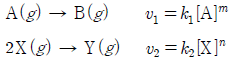
그림 (가)와 (나)는 2개의 강철 용기에 A와 X를 각각 넣고 반응시켰을 때, 시간에 따른 반응물의 농도를 나타낸 것이다. 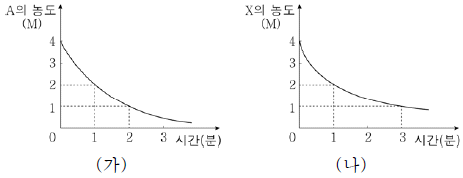
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은? (단, 온도는 일정하고 역반응은 일어나지 않는다.) [3점]
- ㄱ
- ㄷ
- ㄱ, ㄴ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
19. 다음은 약염기 B(aq)의 이온화 반응식과 이온화 상수(Kb)이다. 
그림은 B wg이 녹아 있는 B(aq) 10 mL를 0.5 M HCl(aq)으로 중화 적정한 결과를 나타낸 것이다. 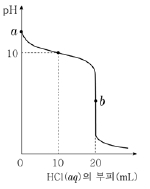
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은? (단, 온도는 25 ℃로 일정하고, 25 ℃에서 물의 이온곱 상수(Kw)는 1 × 10-14이다.) [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ
20. 다음은 TK에서 기체 A와 B가 반응하여 기체 C가 생성되는 열화학 반응식이다. 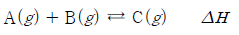
그림 (가)는 TK일 때 부피가 1 L인 강철 용기에서 이 반응이 평형에 도달한 상태를, (나)는 (가)에 B 0.2몰을 추가하여 새로운 평형에 도달한 상태를, (다)는 (나)에서 온도를 높여 새로운 평형에 도달한 상태를 나타낸 것이다. 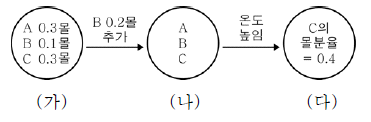
이에 대한 옳은 설명만을 <보기>에서 있는 대로 고른 것은? (단, (가)와 (나)의 온도는 같다.) [3점]
- ㄱ
- ㄴ
- ㄱ, ㄷ
- ㄴ, ㄷ
- ㄱ, ㄴ, ㄷ






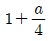
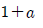
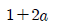
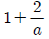
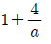
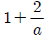 " 이다.
" 이다.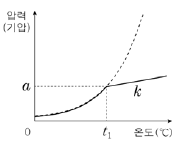



 "이다.
"이다.